BIOLOGIA
Composición de los seres vivos: bioelementos y biomoleculas
Análisis químico de los seres vivos, composición cuantitativa, en los seres vivos es igual, composición de los seres vivos, corteza y planeta no coinciden, los elementos no están elegidos ni al azar ni por su cantidad.
C ------ 1% ------ 18% en seres vivos
Los elementos químicos tienen propiedades vitales para los seres vivos, 16 elementos son comunes entre los seres vivos, siempre aparecen agrupados en la tabla periódica por sus propiedades comunes. Hay dos:
- Bioelementos ---- elementos que se encuentran en la materia viva en mas del 0.1%, son: C, H, O, N ---- 95% y S, P, Ca, Mg, Cl, Na, K ---- 4.5%
- Oligoelementos ---- se encuentran en pequeñas cantidades, menos del 0.1% en los seres vivos, son: I, F, Fe
Estos elementos tienen bajo peso atómico. Peso atómico inversamente proporcional a la estabilidad del enlace covalente (de la materia orgánica)
Teoría de enlace: (alta estabilidad)
- Ultima capa de electrones completa (gases nobles, son estables)
- Resto de elementos forman enlaces para completar su ultima capa de electrones
Na(1), Cl(7) ---- falta poco para ser gas noble
Na(+) Cl(-) ---- la carga positiva y la carga negativa se atraen ---- enlace iónico (enlace de baja energía) ---- se encuentran en la materia inorgánica
C (4) le falta mucho ---- enlace covalente (enlace de alta energía) ---- obtenemos energía los seres vivos = energía química
H2O:
- Electrónicamente neutra (covalente)
- Electronegatividad distinta
- Eléctricamente cargada
- Dipolo (positivo H+ y negativo O-
- Enlace covalente dativo
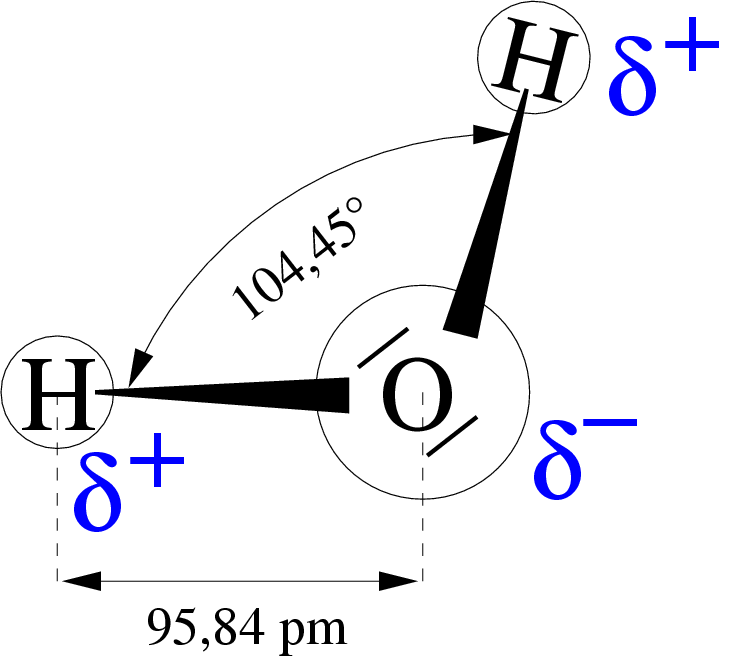
Su bajo peso atómico por su alto calor especifico es 6.3 (ley)
Calor específico: cantidad de calor que necesita una sustancia para aumentar mas de 1ºC en un segundo (desprende mucho calor cuando se enfría)
Metabolismo
Son reacciones químicas que hacen el funcionamiento de los seres vivos.
A + B --- C
Las reacciones tienen que ir a una velocidad en tiempo real
E + A + B ---- C (intercambios de energía)
Las reacciones químicas se interrelacionan con átomos de alto calor especifico.
La temperatura es la medida de la energía térmica (agitación de las partículas)
El calor es una energía.
En nuestras reacciones químicas necesitamos que sean entre átomos con alto calor específico.
Amortigua los cambios de temperatura.
Iones monovalentes
Cl-, Na+, K+ son fundamentales para la creación y el mantenimiento de los gradientes eléctricos ---- carga y químicos ---- salubre
Gradiente ---- es una variable que sigue una línea.
Lo que varia la presión osmótica = a la concentración de soluto ---- difusión.
Difusión ---- movimiento de aquí para allá por la presión osmótica.
Iones divalentes
Fe++, Mg++, Mn++, Cu++, Ca++ aceptan y ceden muy fácilmente electrones (cascada, transportadores de electrones.
En esos paso obtenemos la energía (ATP) son muy necesarias
E---- ATP
Los electrones solo pueden ir hacia abajo.
Colaboran con enzimas, catalizan reacciones químicas en las que se intercambian electrones.
Catalizador---- acelera las reacciones
(C, H) (O, N) = 95% ---- tienen electronegatividades muy diferentes (las células son polares con carga eléctrica = solubles en agua)
(C, N) ---- se oxidan o se reducen, tiene la misma afinidad.
Reacciones de oxidorreducción ---- redox (muchas reacciones del metabolismo.
- Oxidar (se pierde energía).
- Reducir (se gana energía).
Carbono
Es el esqueleto de la materia orgánica 18%, en la corteza solo hay 1%.
- Le permite crear 4 enlaces covalentes, los puede formar consigo mismo o con otros elementos (la mayoría).
- Los enlaces covalentes son estables (permite la estabilidad de la materia orgánica) y forman anillos (hexagonales, pentagonales).
- Tiene 3 dimensiones, son tridimensionales no son planos (las moléculas tienen forma en el espacio).
- Cadenas longitudinales, de anillos, de forma distinta (se pueden hacer infinitas cadenas de C distintas)
El silicio (Si) también tiene 4 enlaces covalentes, pero tienen un alto peso molecular, lo que hace que sean inestables y por eso no se pueden unir entre ellos.
Propiedades de los oligoelementos
No se sabe muy bien cuales son sus funciones. Su falta provoca graves trastornos y su exceso es toxico.
Se conocen 60 oligoelementos y 14 son solo comunes en los seres vivos ---- Fe, Mn, Cu, Zn, F, I.
Fe (hemoglobina), I (forma la hormona tiroidea, bocio), F (esmalte de los huesos y de los dientes).
Características de las biomoleculas
En un organismo hay el 70% H2O y 30% peso seco.
Peso seco (95% materias orgánicas y 5% sales + gases.
Biomoleculas:
- Inorgánicas (H2O, sales, gases)
- Orgánicas (proteínas, glucidos, lípidos, ácidos nucleicos)
Son macromoléculas formadas por 10 millones de átomos (ADN).
Son polimétricas (formadas por monómeros)
- Glucidos ---- monosacáridos
- Lípidos ---- ácidos grasos
- Proteínas ----aminoácidos
- Ácidos nucleicos ---- nucleótidos
Polímetro monómero = glucidos, lípidos
Almidón = Glu-Glu-Glu-Glu · 10 (3)
Grasa = ácidos grasos
Funciones pasivas:
Reserva de energía (almidón, grasas)
Estructural (celulosa, fosfolipidos)
Polímetro monómero distintos a:
- Proteína (20 Aa)
- Acido nucleico (4 nucleótidos)
Aa1- Aa7- Aa9- Aa15 (orden)
ATGCGGGATCGGG (información)
Realizan funciones activas:
Secuencia de Aa determina la forma de la proteína
Secuencia de nucleótidos igual a la información genética
No hay comentarios:
Publicar un comentario