Son catalizadores biológicos que se encuentran en reacción metabólica específicamente.
Todos los catalizadores aceleran las reacciones, tienen importancia primordial en la velocidad de las reacciones.
Los seres vivos somos como una máquina que funciona mediante reacciones químicas, es viable si las reacciones ocurren en tiempo real.
Mecanismo de acción:
Reacciones químicas en general:
Se representan mediante una ecuación química.
A + B ↔ C
Las reacciones del metabolismo siempre son reversibles. Como son reversibles existe equilibrio.
Cualquier reacción química básicamente consiste en la formación o rotura de enlaces, para ello siempre hay que aportar una cierta energía a la sustancia para que se lleve acabo.
Una enzima, por sí misma, no puede llevar a cabo una reacción, su función es modificar la velocidad de la reacción, entendiéndose como tal la cantidad de producto formado por unidad de tiempo. Tal variación se debe a la disminución de la energía de activación.

La energía de activación es la mínima energía necesaria para formar o romper enlaces o la mínima energía necesaria para convertir un mol de sustrato en un mol de producto.
Otra característica es que entre el sustrato y el producto hay un compuesto intermedio de transición llamado complejo activado.
El complejo activado se caracteriza porque los enlaces están medio formados o medio rotos, pero además tiene un nivel energético superior porque tiene más energía libre que el sustrato por haber absorbido la energía de activación.
Otra condición sería, la necesidad que se encuentren los sustratos para que haya reacción y además tienen que colisionar para que se forme C, pero no colisiona de cualquier forma, tiene que ocurrir una geometría de la colisión → colisiones correctas que desembocan en la formación del complejo activado para que de lugar al producto.
Toda la energía es aprovechada, si no es correcta se pierde. Si la energía es suficiente y la geometría de colisión es correcta se forma el complejo activado que da lugar al producto, si falta una de las dos condiciones se vuelve al sustrato y no hay reacción.
La facilidad o dificultad con la que ocurre una reacción (velocidad) depende de la energía de activación. Cuando la energía de activación es baja, no se necesita aportar energía a la reacción porque la temperatura ambiental es suficiente, la agitación térmica de los sustratos o la luz que les llega es suficiente. Estas reacciones se llaman reacciones espontáneas.
La velocidad también depende de la energía de la reacción → energía del sustrato menos energía del producto. Si la diferencia es positiva, la reacción es exotérmica (desprende energía). Si la diferencia es negativa, lareacción es endotérmica (necesita energía).
Las enzimas igual que los catalizadores actúan en muy bajas concentraciones, disminuyen la energía de activación haciendo que las reacciones sean espontáneas porque toda la energía se invierte para formar o romper enlaces. Ninguna energía se pierde en colisiones incorrectas.
Los catalizadores se recuperan intactos, no se consumen en la reacción, pero si intervienen en la reacción. facilitan la geometría de la colisión al unirse a los sustratos y bajan la energía de activación y además facilitan el desarrollo de la reacción. Todo esto lo realizan sin alterar el equilibrio de la reacción.
Características, catálisis enzimática:
1.-Complejo Enzima-sustrato y complejo activo:
Se forma un complejo entre Enzima-Sustrato
E + S ↔ ES ↔ E + P
Es un complejo intermedio que rápidamente se va a producir en el producto.
Esta unión se da en la superficie de la enzima, donde hay un surco, el centro activo, que sirve para reconocer al sustrato por su forma. La forma del centro activo y del sustrato son complementarias y esteroespecíficas por su esteroespecificidad
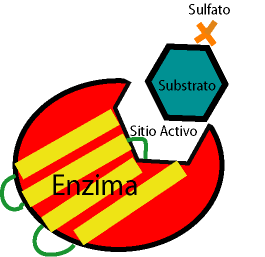
Cuando el sustrato se encuentra en el centro activo por complementariedad de sus formas, el sustrato se pone en contacto con aminoácidos, se establece unas fuerzas de Van der Waals y da lugar a interacciones iónicas (los aminoácidos se llaman aminoácidos de unión).
Los aminoácidos de unión interaccionan débilmente con ciertos grupos químicos des Sustrato formando enlaces débiles.

El modelo llave-cerradura o mejor mano-guante explica como se complementan la enzima y el sustrato.

La unión pone en contacto al sustrato con otros aminoácidos del centro activo, llamados aminoácidos catalíticos, mediante interacciones débiles.
Los aminoácidos catalíticos debilitan el enlace a romper en la reacción o exponen grupos químicos del sustrato que se van a enlazar, favorecen el desarrollo de la reacción.
Kosland decía que los aminoácidos esenciales son:
- Aminoácidos de unión
- Aminoácidos catalíticos
- Todos los aminoácidos que mantienen la forma de la enzima.
No necesariamente los aminoácidos de unión y los catalíticos van seguidos, aparecen juntos en el centro activo por los pliegues de la cadena, por la forma de la proteína.
2.- Especificidad:
La enzima reconoce al sustrato por su forma (complementaria con la del centro activo), por esteroespecificidad. A cada enzima le corresponde un sustrato, a esto se le conoce como
especificidad de sustrato.
Esta especificidad de sustrato es total (hasta los isómeros) de grupos químicos del sustrato, reconoce a ciertos grupos químicos. En este caso se habla de especificidad de grupo .
Los aminoácidos de unión también tienen un papel muy importante en la especificidad, ya que determinan la especificidad de sustrato.
Además cada enzima sólo realiza un tipo de reacción química, la que le permite sus aminoácidos catalíticos, especificidad de acción.
3.- Cofactores y vitaminas:
Muchas enzimas necesitan sustancias no proteícas para su funcionamiento. Se unen débil y momentáneamente a la enzima los grupos no prostéticos unidos de manera covalente, fuerte y permanente.
Los cofactores son iones metálicos ( Fe, Mg, Mn, Ca, Zn). Colaboran en la unión o en la catálisis ( enzima-sustrato).
Las coenzimas son moléculas orgánicas que no colaboran en la unión ni en la catálisis, actúan como aceptores temporales de grupos químicos ( transportadores de grupos químicos entre sustratos ).
Ejemplo:
Deshidrogenadas → quitan hidrógeno al sustrato pero no lo pueden conservar intactos.
Coenzima redox:
sustrato reducido NAD+ sustrato oxidado
oxidasa ↓ ↓ ↑ ↓ reductasa
sustrato oxidado NADH sustrato reducido
nicotinaminadenindinucleótido
Quinasas (toman) y fosfatasas (ceden)
NADP+, FMN+ , FAD+
Enlaces de alta energía con el fósforo inorgánico ~Pi, aceptan coenzimas transportadores de energía.
PEP ADP GLUC
quinasa ↓ ↓ ↑ ↑ fosfatasa
P ATP G-L-P
ADP + ~Pi ↔ ATP moneda energética de la célula
ATP → adenosintrifosfato UTP / GTP / TTP
ADP → adenosindifosfato
Todos son derivados de nucleótidos, todos los seres vivos pueden fabricarlos.
Coenzima A, no es derivada de los ácidos nucleicos, no podemos fabricarla, la tenemos que obtener de la dieta, derivadas de las vitaminas.
Vitaminas:
Todas las vitaminas se necesitan en pequeñas cantidades porque colaboran con las enzimas que también están en pequeñas cantidades.
Son esenciales para el metabolismo, actúan como coenzimas.
La falta de vitaminas produce enfermedades carenciales, los síntomas son el resultado del déficit de ciertas reacciones metabólicas (las que necesitan esos coenzimas). Enfermedades características de la falta de vitaminas son: pelagra, escorbuto, beri-beri. Sus síntomas desaparecen instantáneamente al incorporar a la dieta vitaminas. Se conoce con el nombre de avitaminosis (falta de vitaminas).
Las vitaminas se clasifican por su composición, pueden ser:
- hidrosolubles (solubles en agua) → actúan como coenzimas o grupos prostéticos, el exceso se elimina a través de la orina.
- liposolubles (solubles en lípidos) → sólo ocasionan problemas hepáticos, su exceso es tóxico.
4.-Mecanismo para aumentar la eficacia enzimática:
Son sistemas multienzimáticos y de compartimentación.
La velocidad de las reacciones aumenta cuando están acopladas.
A → B → C → D
Se encuentran acopladas cuando el producto de una reacción es el sustrato del siguiente. esto permite mayores concentracciones del sustrato y con ello mayor velocidad de las reacciones.
el mismo efecto se consigue con la compartimentación. Dentro de un mismo compartimento hay más concentración que fuera, en el citoplasma hay concentracciones pequeñas y en el orgánulo (compartimento) concentracciones altas.
En los seres vivos las enzimas asociadas forman complejos multienzimáticos que catalizan la secuencia.
Además están asociados a membranas, ocurren dentro de un compartimento (el orgánulo).
5.- Cinética de las reacciones catalizadas y enzimas: ecuación de Michaelis-Menten:
Tienen la misma cinética que la de las reacciones en general.
Presentan una peculiaridad, saturación por sustrato , exclusiva de las enzimas.

Primera fase, la concentración es directamente proporcional a la concentración del sustrato (2=2).
Segunda fase, la velocidad no es directamente proporcional a la concentración del sustrato (v=5, s=3).
Tercera fase, la velocidad no aumenta aunque se le eche más sustrato, está saturada.
El enzima está en baja concentración, está todo ocupado, por más sustrato que se le añada no aumenta la velocidad.
La ecuación de Michaelis-Menten explica la cinética, relacionando velocidad con concentración de sustrato y ciertas características del enzima.
![v = \frac{V_{max}[\mbox{S}]}{K_m + [\mbox{S}]}](http://upload.wikimedia.org/math/f/1/8/f18456dcd1d181d08cab917a783bd12a.png)
Km, es la concentración del sustrato donde la velocidad de la reacción es la mitad de la máxima.
Cada enzima tiene su KM, típico de cada enzima.
La KM también es una constante de equilibrio de esa reacción.
E + S ↔ ES |S| • |E|
KM = ─────
|ES|
Si la KM es alta necesita más concentración de sustrato.
La KM es inversamente proporcional a la afinidad de la enzima con el sustrato.
Si una enzima tiene varios sustratos, tiene una KM para cada uno.
El KM varía con la temperatura, con el pH, con las coenzimas y cofactores.
La velocidad máxima es otra característica de la enzima, cada enzima tiene una velocidad y también varía con cada sustrato, temperatura, pH, coenzimas y cofactores.
La mejor KM y velocidad máxima se da a una temperatura óptima (37ºC para las enzimas), pH óptimo (6, 5-7) y las concentraciones de coenzimas también son óptimas.
5.1.-Factores que influyen en la velocidad de las reacciones enzimáticas:
Ecuación de Michaelis-Menten.
La concentración de sustrato influye en la velocidad.
V → =|S|
V → |S|
V → # |S| = V máx.
pH óptimo (6, 5-7), tanto si es alto como bajo la velocidad disminuye (el pH afecta a la forma del enzima, a los amínoácidos de unión y a los aminoácidos catalíticos, por tanto al funcionamiento del enzima), a la velocidad de reacción.
Temperatura óptima (37ºC), si la temperatura baja no se llega a alcanzar la energía de activación. Si la temperatura sube, las proteínas se desnaturalizan.
Coenzimas y cofactores, concentraciones óptimas, si es baja la concentración la velocidad se resiente.
6.-Clasificación y nomenclatura de las enzimas:
Clasificación según su acción química:
○ Deshidrogenadas
○ Hidrolasas
○ Oxidasas
○ Descarboxilasa
Nomenclatura:
○ sustrato/s + acción química que realiza + asa
ejemplo:
succinico deshidrogenasa → succinico quita hidrógenos
piruvico descarboxilasa → piruvico quita dióxido de carbono
glucógeno fosforilasa → glucógeno de fósforo
7.-Regulación (modificaciones) de la acción enzimática:
La cinética enzimática se ve modificada por parámetros generales, concentración de sustrato, concentración de coenzimas y cofactores, subir la temperatura y bajar el pH.
Estos parámetros son inespecíficos, afectan a todas las enzimas, no sirven para regular la actividad enzimática.
La verdadera regulación de la actividad enzimática (reacciones metabólicas) se realiza a nivel de enzima, modificando su velocidad de actuación.
A nivel de los genes a partir de los que se sintetizan los enzimas (ácidos nucleicos).
Es necesario porque el medio es cambiante, las necesidades celulares también varían.
Se necesita regulación de la actividad enzimática por economía celular (sólo ocurren las reacciones metabólicas necesarias a la velocidad adecuada).
Los mecanismos de regulación son la activación / inhibición enzimática más la que realizan los llamados enzimas reguladores (alostéricos y modulados covalentemente).
Activación / inhibición enzimática:
La acción enzimática dependía de la concentración del sustrato y de la concentración de coenzimas y cofactores, con ellos se activa, sin ellos no funciona, no es una verdadera regulación, sí lo es la que producen ciertas sustancias inhibidoras capaces de disminuir la velocidad de las reacciones e incluso hacerlas cero.
Inhibición enzimática:
○ Inhibición irreversible (nunca volverá a actuar correctamente), insecticidas, mercurio (Hg), son capaces de unirse a ciertos aminoácidos esenciales del enzima covalente, permanentemente alterándolos irreversiblemente, se conocen como venenos metabólicos.
○ Inhibición reversible, hay varios tipos, sólo se distinguen experimentalmente por su efecto sobre la cinética enzimática. Tres tipos:
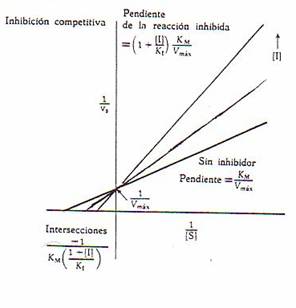
1.-Inhibición competitiva:
El inhibidor es semejante químicamente al sustrato, compite con el sustrato en su unión al centro activo y se produce dos reacciones.
Con el inhibidor aumenta la KM "aparentemente".
Experimentalmente, aumentando la concentración de sustrato y anteniendo la concentración de inhibición aumenta la velocidad y disminuye la inhibición, es inhibición competitiva.
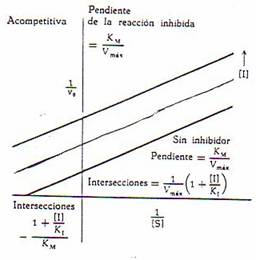
2.-Inhibición acompetitiva:
El inhibidor no es semejante al sustrato, no compite con el sustrato para unirse al centro activo, no se combina con el enzima libre, se combina con el complejo enzima-sustrato.
Se distingue experimentalmente, se aumenta la concentración de sustrato y se mantiene constante la concentración del inhibidor y del enzima, disminuye la velocidad y aumenta la inhibición, es inhibición acompetitiva.
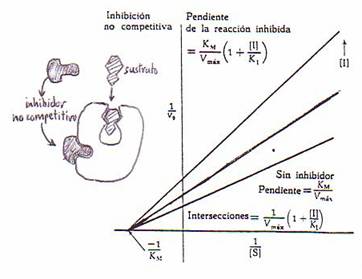
3.-Inhibición no competitiva:
El inhibidor se une al enzima por un lugar distinto al centro activo, se dan tres reacciones: buena, competitiva y acompetitiva.
Se aumenta la concentración del sustrato y se mantiene la concentración del inhibidor y del enzima, la velocidad permanece igual.
E + S ↔ ES ↔ E + P V↑
E + I ↔ EI V=
↑ES + I ↔ ↑ESI V↓
Enzimas reguladores:
Algunos son específicos para regular, son capaces de modificar el estado metabólico de las células en muy poco tiempo, son los enzimas alostéricos y modulados covalentemente.
Enzimas alostéricos:
Etimológicamente alostérico significa "otro sitio".
Además de centro activo presenta centro alostérico.

Los moduladores pueden ser positivos o negativos, el positivo activa al enzima y el negativo inactiva al enzima.
Cuando tienen uno se llaman monovalentes, si tienen dos o más (positivo y negativo) se llaman polivalentes.
Si son polivalentes cada modulador tiene su centro alostérico.
Los enzimas alostéricos se encuentran siempre al principio.
L-Treonina E1→ E2 →E3→E4→E5→ L-Isoleucina
L-Treonina se encuentra al principio de una secuencia multienzimática.
L-Isoleucina es el modulador negativo de la L-Treonina deshidratasa.
Si hay L-Isoleucina no funciona, deja de funcionar la L-Treonina.
Sirve para mantener constante la concentración de L-Isoleucina.
Es un mecanismo de control que se llama retroalimentación negativa. La salida influye sobre la entrada y negativa porque el signo de la salida es distinto al de la entrada (utilizado en cisternas, termostatos, etc...)
Este mecanismo se utiliza para mantener constante una variable, sirve para regular.
En retroalimentación positiva, el modulador es positivo, sirve para maximizar una variable, para conseguir una respuesta máxima.
Si aumenta en la salida, aumenta la entrada.
Se encuentran al principio de una secuencia multienzimática (un enzima alostérico regula a otros cuatro, L-Treonina deshidratasa)
Si se encuentra en una encrucijada metabólica controla todas las reacciones e influye en todas las demás.
Red de control, varias secuencias enzimáticas reguladas cuyo producto final activa el enzima alostérico.
Enzimas modulados covalentemente:
Se caracterizan porque tienen dos formas, una más activa (mayor velocidad) y otra menos activa (menor velocidad), se diferencian en las modificaciones covalentes de su estructura.
Glucógeno Fosforilasa » Glucógeno + ATP → G-1-P + (glucosa) n-1 + H2O
reacción esencial ante las situaciones de emergencia
Interconvertibles mediante cambios / modificaciones covalentes de su estructura, catalizadas por otras enzimas a su vez.
Libera la glucosa de su almacen (glucógeno) ante una emergencia (almacenada en el hígado).

Tiene dos formas:
○ Forma más activa, Fosforilasa a , tiene 4 subunidades, cada una de ellas tiene un resto de serina fosforilado que forma un enlace éster entre el -OH de la serina y el -OH del ácido fosfórico.
○ Forma menos activa, Fosforilasa b , tiene 2 subunidades, la serina de las subunidades no están fosforiladas.
La transformación de "a" a "b" la realiza la enzima glucógeno fosforilasa fosfatasa.
La transformación contraria la realiza la enzima glucógeno fosforilasa quinasa.
Fa + 4ADP + 4H2O ↔ 2Fb + 4 ATP
Esto permite amplificar enormemente, rápidamente, una señal. ante una situación de emergencia segregamos adrenalina.
Una molécula de adrenalina activa a 1.000 fosforilasa quinasa, a su vez convierte 1.000.000 Fb en 1.000 Fa y éstas liberan 1.000.000 G-1-P a disposición del músculo.
Estoy tomando suplementos de enzimas digestivas para mejorar mi digestión, sobre todo con algunos alimentos más pesados o que llevan demasiada grasa. Me funcionan muy bien y los recomiendo.
ResponderEliminar