PROTEÍNAS:
Concepto e importancia biológica:
Etimológicamente, proteína viene del griego.
Proteos, infinitas formas que representan las proteínas.
Proteios, el primero.
Las proteínas son cuantitativamente moléculas más abundantes de los seres vivos (+50% peso seco).
Cualitativamente, altas funciones que realizan.
Funciones:
- Catalizadores, enzimas
- Reguladoras, hormonas
- Movimiento, músculos
- Estructural, pelo
- Defensiva, anticuerpos
- Transporte, hemoglobina
Lípidos y glúcidos, funciones pasivas e inertes.
Las proteínas presentan actividad biológica, se diferencian porque son polímero de monómeros distintos porque existen 20 aminoácidos diferentes.
Presentan secuencias, orden Aa es una información porque la secuencia Aa determina forma de la proteína y la forma de la función.
Definición, polímeros lineales de aa., forman unas macromoléculas que tiene peso molecular, PM =10(4)- 10(6).
Son moléculas bastante complejas, se montan y se desmontan con bastante facilidad, explica las características de los seres vivos, la renovación constante de la materia viva.
Proteína se rompe por hidrólisis, aparece polipéptidos (+10 Aa), aumentando la temperatura, aumentando el pH.
Los polipéptidos se rompen en cadenas más pequeñas, llamados péptidos (2-10 Aa), cuando se rompen dan lugar a 20 Aa.
Aminoácidos:
Monómeros de las proteínas.
Todos tienen en común un grupo amino y un grupo ácidos

Propiedades:
1.-Carácter ácido/básico:
Se comportan como ácidos a pH básicos y como bases a pH ácidos.
Curva de titulación de alanina (Aa):

Alanina en el 6, punto isoeléctrico, valor de pH en el que hay tantas cargas positivas como negativas.
Si se cambia el pH cambian las cargas eléctricas.
2.Polares:
Son solubles en agua
Son cristalizables tienen alto punto de fusión, por las cargas eléctricas.
3.-Isomería espacial y óptica:
Carbonos asimétricos es el carbono alfa.
Se mira el grupo amino, a la derecha, D-Aa, a la izquierda, L-Aa.
En la naturaleza predomina los L-Aa.
Isomería óptica, desviar la luz polarizada.
La glicocola no presenta carbono asimétrico ni isomería óptica.
Clasificación de los aminoácidos:
Se clasifican según su radical, a pH 7.
No polares
Polares sin carga
Polares con carga negativa
Polares con carga positiva.
Enlace peptídico:
Une a los Aa.
Se establece entre un ácido y un amino
Se forma un enlace peptídico y se desprende una molécula de agua.
Al principio siempre hay un grupo amino que queda libre y el último aminoácido de la cadena es el que tiene el grupo ácido libre.
Estos átomos se llaman átomos peptídicos, tienen que estar en el mismo plano, porque es un enlace resonante (enlace peptídico tiene el mismo porcentaje en enlace sencillo y en enlace doble).
No pueden girar, sólo giran todos menos los del enlace peptídico.
Comparten tantos electrones entre ellos que tienen que estar en el mismo plano.
Lo más importante es el giro del carbono alfa, si gira arrastra al radical y determina la forma de la proteína.
Al formarse los enlaces peptídicos se produce una línea quebrada de los átomos peptídicos y de los carbonos asimétricos, en los que los radicales quedan alternativamente hacia arriba y abajo en la línea quebrada.
Estructura de las proteínas:
2 Aa unidos a un enlace peptídico, dipéptido
2-10, péptido
+10, polipéptido
Siendo proteína la formada por 10 o más polipéptidos.
Estructura primaria:
Cada proteína formada por ciertos Aa que están en un determinado orden, se llama secuencia de aminoácidos de una proteína.
Es característica de cada proteína y específica de ella, sería su estructura primaria.
Determina las restantes estructuras, función y propiedades.
Como la especificad de especie.
Una misma proteína presenta diferentes estructuras primarias en las diferentes especies.
En las proteínas encontramos unos Aa esenciales, para la función o la estructura de la proteína, no varían a lo largo de la evaluación.
El resto de los Aa (no esenciales) son los que varían de una especie a otra.
Estructura primaria es extendida.
Cuando se conoció la estructura primaria se supuso que todas las proteínas eran extendidas, que no había más estructuras. Difracción de rayos x.
Cuando se hizo una radiografía, las proteínas presentaban una forma tridimensional espacial, se llama estado nativo.
Es la forma de la proteína, la que tiene mas enlaces, más estable, menos energía libre.
Era el resultado de varios niveles estructurales, todos dependientes de la estructura primaria.

Estructura secundaria:
Son el resultado de los giros de los carbonos asimétricos.
Alfa-helice
Se produce al girar los carbonos asimétricos siguiendo una hélice alrededor de un eje imaginario.
Este giro es de 3,6 Aa por vuelta.
El Aa en posición 1 queda enfrente del Aa en posición 5.

Los átomos peptídicos quedan enfrentados cada 4 Aa, quedan enfrentados en la posición geométrica correcta (distancia y orientación).
Para formar todos los puentes de hidrógeno posibles entre ellos, puentes de hidrógeno intracatenarios, son los que se mantienen alfa-hélice.
Los radicales se quedan fuera de la hélice.
Beta-hoja plegada:
Se produce cuando los carbonos asimétricos actúan como puntos de plegamiento de la cadena.
Se mantienen por puentes de hidrógeno, que se producen a través de cadenas paralelas (no en la misma cadena), se llama puentes de hidrógeno intercatenarios.

Triple hélice del colágeno:
Forma hélice pero en su estructura primaria abundan los Aa llamados prolina e hidroxiprolina (son Aa con grupo amino ciclado, carece de hidrógeno para formar puentes de hidrógeno).
No forman puentes de hidrógeno intracatenarios, se forma una hélice más extendida con puentes intercatenarios, como una cuerda de 3 cabos (3 hélices).
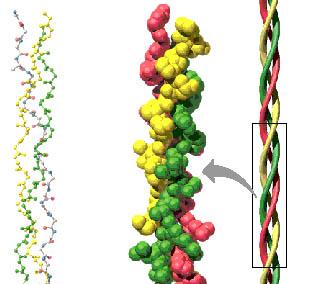
La estructura secundaria no son puras, no están completamente estructuradas ni de un solo tipo, hay alfa-hélice, beta-hoja plegada, discontinuidades no hay estructura secundaria.
Conjunto de las estructuras secundarias más discontinuidades es el estado nativo de la estructura terciaria, forma espacial.
Estructura terciaria:
Conjunto de estructura secundaria más discontinuidades.
Causas de las discontinuidades:
-Prolina / hidroxiprolina, rompen la estructura secundaria porque no forman puentes de hidrógeno (amino ciclado).
-Aa con radicales apolares, son hidrófobos o lipófilos, se introducen dentro de la cadena de la estructura secundaria (huyen del agua buscan el ambiente lipófilo del interior), especialmente si son voluminosos.
-Aa cercanos con cargas iguales o distintas, si se atraen como si se repelen.
-Cisteína, presenta un grupo HS, si se encuentran dos cisternas enfrentadas en la posición geométrica correcta se produce entre ellas puente de disulfuro.
La estructura terciaria es el conjunto de sus estructuras secundarias más sus discontinuidades.
Si una proteína sólo tiene estructura terciaria es su estado nativo.
Por la forma que tiene los Aa están más cercanos.
La estructura terciaria se mantiene gracias a unos enlaces nuevos resultantes de la forma de la proteína.
Enlaces:
-Interacciones iónicas, Aa con carga positiva y otro con carga negativa (Aa ácido con básico).
-Puentes de hidrógeno, H---O/N cargados, oxígeno/nitrógeno electronegativos.
-Fuerzas de Van de Waals, atracciones eléctricas entre cargas fluctuantes.
-Interacciones hidrofóbicas, los radicales apolares se meten dentro de la cadena por ser hidrófobos y se unen entre sí por ser lipóficos.
Todos los enlaces anteriores son débiles, pero como son numerosos pueden sostener la estructura terciaria, estabilizan la estructura.
Enlace fuerte, puentes de disulfuro, enlace covalente entre cisteína.

Estructura cuaternaria:
Es el estado nativo de la proteína (forma9.
Tienen estructura cuaternaria aquellas proteínas que tienen subunidades.
Hemoglobina esta formada por la unión de 4 subunidades.
Estructura cuaternaria uniones de subunidades con estructura terciaria.

Los enlaces mantienen la estructura cuaternaria, aparecen al unirse las subunidades.
Los enlaces son los mismos que en la estructura terciaria, excepto los puentes disulfuro.
Los enlaces de la estructura cuaternaria son débiles.
Todos los enlaces que mantienen el estado nativo son débiles, se modifican fácilmente según el ambiente al que están sometidos y según su función.
La función depende de la estructura y ésta determina que ciertos radicales en superficie sean capaces de interaccionar débilmente con un ligando (enzima-sustrato, antígeno-anticuerpo, hemoglobina-oxígeno), para unirse a él y otras interacciones realizan su función.
En el momento en que se encuentran unidos, otro radical debilita un enlace y lo rompe.
Los radicales que ayudan a la unión son Aa esenciales, también son esenciales los que mantienen la estructura, los demás Aa son de relleno.
Los aa se encuentran a cada lado de la cadena, no necesariamente seguidos en la cadena, aparecen juntos por a forma de la proteína, en un surco de la superficie, llamado centro activo.
Propiedades de las proteínas:
Solubilidad en agua:
Son relativamente solubles en agua, porque las dos terceras partes del Aa (R) son polares.
Las proteínas tienen tamaño muy grande y no forman disoluciones, forman dispersiones coloidales.
Especificidad:
Las proteínas son diferentes en distintas especies e incluso en distintos individuos.
Los Aa esenciales (catalíticos en enzimas), los de unión, los que mantienen la estructura, estos aa no cambian ni de una especie a otra, ni en los individuos, lo que cambian son los radicales (relleno).
Son tantas las combinaciones posibles que lo extraño sería que fueran iguales.
El sistema inmunitario conoce la estructura primaria de nuestras proteínas, reconoce lo extraño y envía una respuesta inmunitaria cuando reconoce una infección, rechaza órganos transplantados o transfusión sanguínea errónea.
Cuando cambia Aa esencial produce una enfermedad, mutación.
Anemia fácil forma, los glóbulos rojos normales tienen forma de disco bicóncavo, en vez del ácido glutámico (ácido) hay valina (neutro)
Este cambio en la estructura primaria afecta a la secundaria, terciaria y cuaternaria de la hemoglobina (transporte de O2) y la vuelve anormal, afecta a los glóbulos rojos que presentan forma de media luna, as personas tienen problemas oxigenan mal, tienen anemia perniciosa (el baso destruye todos los glóbulos rojos).
Desnaturalización y renaturalización:
El estado nativo se adquiere espontáneamente, depende de la estructura primaria y se mantiene por enlaces débiles, fácilmente se pierde o se altera.
Con aumento o disminución del pH, temperatura, alta concentración de sal o de detergente, la proteína queda desnaturalizada, pierde su forma, su estado nativo, su función y sus propiedades.
Las proteínas se vuelven insolubles (precipitado), los radicales apolares quedan expuestos y se vuelve más apolar, tiene más tamaño, extendida (desnaturalización suave).
Renaturalización, volver a ponerla estructura a sus condiciones normales (pH, temperatura, detergente, sal), espontáneamente vuelve a su estado nativo (desnaturalización reversible).
Si la desnaturalización es más intensa pierde su estructura y no puede volver a su estado nativo, desnaturalización irreversible.
Clasificación y funciones biológicas:
Se clasifican por su composición química:
- Holoproteínas, formadas sólo por Aa
-globulares, albúminas, globulinas, hemoglobina
-fibrosas, queratina (tiene mucha cisteína), pelo, uña, piel, miosina (músculos), colágeno (conjuntivo, óseo, cartilaginoso)
- Heteroproteínas, formadas por Aa y otras sustancias no proteicas, grupo prostético, la unión es permanente. El grupo prostético es el que realiza la función de la proteína. La cadena de Aa aporta el ambiente adecuado para que funcione el grupo prostético.
-glucoproteínas, membrana donde se constituyen las señales de identificación celular (antígenos), algunos anticuerpos también son glucoproteínas (inmunoglobinas), mucina, forma mucus, aparato digestivo, respiratorio.
-fosfoproteínas, caseína-leche, ovoalbúmina-clara de huevo.
-cromoproteínas, anillo tetrapirrólico (pirrol tiene 4 anillos unidos), anillo resonante (dobles enlaces cambian de sitio). Los dobles enlaces le dan color, hay muchos electrones compartidos y además son resonantes, con lo cual hay electrones libres y aceptan y dan electrones (cadena transportadora de electrones), absorben energía (pigmentos, fotosíntesis)
Ejemplos:
Clorofila- pigmentos, fotosíntesis.
Citocromos- cadena transportadora de electrones.
El anillo tetrapirrólico rodea a un metal:
Fe, hemoglobina, citocromos.
Mg, clorofila.
Cu, hemocianina.
-nucleoproteínas, formadas de ácidos nucleicos y proteínas, forma los cromosomas y ribosoma, constituyen la cromatina.
Si clasificamos las proteínas por su función:
-catalizadores, aceleran las reacciones, enzimas.
-reguladoras, modifican la intensidad metabólica, hormonas de la insulina, del crecimiento.
-movimiento, actina y miosina muscular.
-defensivas, anticuerpos, sistema inmunitario.
-transporte, hemoglobina, oxígeno en sangre, mioglobina, oxígeno en músculos.
-estructural, pelo, uñas, cilios, flagelos de la membrana.
Buen trabajo, para el que te recomiendo que siempre expliques todos los conceptos que aparezcan y que siempre que puedas añadas imágenes, enlaces, videos como permite el blog, para ilustrarlas.
ResponderEliminar